|
|||||||||||||||
|
Lunes 3 de julio de 2006 Investigadores del Laboratorio de Biología Molecular Transducción de Señales, dirigido por la doctora Silvia Moreno de Colonna, indagan el funcionamiento de la proteína quinasa A, una enzima involucrada en procesos vitales como el funcionamiento de las neuronas, la adquisición de la memoria o en el crecimiento o diferenciación de la célula, entre otros. Por Cecilia Draghi (*)
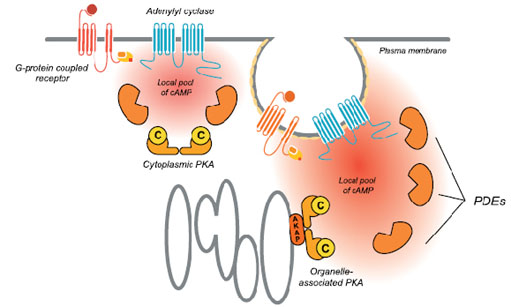
Mientras usted lee estas líneas, millones de células del organismo intercambian información entre sí. Reciben estímulos de hormonas u otras sustancias, a las que responderán luego de un delicado y complejo mecanismo interno, que puede modificar para bien o para mal su propia existencia. Este mundo microscópico tiene sus códigos y reglas que el hombre ha tardado siglos en desentrañar, y que aún tiene numerosos agujeros negros por develar. En este camino se encuentra el Laboratorio de Biología Molecular Transducción de Señales, dirigido por la doctora Silvia Moreno de Colonna. Desde hace veinte años, el equipo ha centrado la mirada en el mundo interior de la célula, más precisamente en el proceso de transducción de señales. En cualquier momento, las células pueden recibir señales que las llevan a realizar determinadas actividades para cumplir con la misión indicada. Ejemplos de señales son las hormonas en mamíferos, o factores nutricionales en microorganismos. Cómo las células obtienen la orden y cómo llevan a cabo la indicación es una cuestión que inquieta a los científicos. Es que en numerosos casos se conoce el receptor con el que interaccionan, así como el resultado final de la transducción de esa señal, pero no se sabe qué ocurre en el interior de las células. “Uno de los objetivos de este equipo de trabajo es desentrañar el mecanismo por el cual se transduce la señal desencadenada por hormonas o factores de crecimiento o nutricionales, una vez que éstos interaccionan en la superficie de la célula con receptores específicos. Estas hormonas o factores de crecimiento que son llevados por la sangre, o se encuentran en el medio de cultivo en el caso de microorganismos, son denominados “primer mensajero”. En particular, -destaca la doctora Moreno- a su grupo le interesa la señal que, como consecuencia de esa interacción primer mensajero-receptor en la superficie de la célula, produce el aumento dentro de la misma de una pequeña molécula denominada AMP cíclico. Esta molécula se desempeña como segundo mensajero, ya que es la encargada de continuar el camino de señales iniciado por el primer mensajero”. Una vez en el interior celular, el AMP cíclico tiene como primer blanco conocido la proteína quinasa A, antes denominada proteína quinasa dependiente del AMP cíclico. Hasta aquí la ciencia ha logrado descifrar el mecanismo, pero qué ocurre luego es uno de los objetivos pendientes de este rompecabezas. En el genoma humano hay alrededor de mil proteínas quinasas distintas, entre las cuales se encuentra la proteína quinasa A . Todas actúan en procesos regulatorios y cada una responde a señales diferentes. Qué pasa en el interior de la célula una vez que esto sucede es uno de los objetivos a dilucidar. Cómo lo estudian El equipo dirigido por la doctora en química Moreno de Colonna tiene como modelo de estudio a hongos y levaduras, es decir eucariotas inferiores. Éstos, si bien difieren en numerosos aspectos del ser humano, un eucariota superior, comparten numerosos elementos del mecanismo interno celular. Los hongos del género Mucor y la levadura Saccharomyces cerevisiae (comúnmente conocida como levadura de panadería) son tomados como modelos porque tienen la ventaja de simplificar el problema, dado que no presentan la complejidad del ser humano. Con este modelo, el equipo sigue de cerca la recorrida o el proceso de transducción de señales en el interior celular. Como ya se ha dicho, las proteínas quinasas son el primer blanco conocido. “Se trata –explica– de enzimas capaces de catalizar la reacción de transferencia de un fosfato de carga negativa, a una proteína, y convertirla en una proteína fosforilada. Esta característica lleva a que una proteína que se hallaba estable, al incorporar un fosfato forzosamente registre un cambio, porque pasa de estar equilibrada a recibir un fosfato con dos cargas negativas en un lugar donde antes no había aminoácidos cargados. ¿Qué puede ocurrir? “Varias cosas. Una posibilidad –responde la especialista– es que modifique la forma de la proteína para poder amoldarse a tener esas dos cargas negativas y enfrentarle dos cargas positivas, y para lograr esto deberá cambiar un poco su estructura. Esto seguramente le hará variar alguna de sus propiedades haciéndola más o menos eficiente, si es que esa proteína es una enzima, por ejemplo. En otros casos, la fosforilación, aunque no desencadene un cambio importante en la estructura de la proteína en sí, puede afectar su interacción con otra”. En otras palabras, para bien o para mal, esta proteína ya no será lo que era. Cualquiera de las posibilidades que adopte ocurrirá en cierto tiempo y resultará transitoria. “Es que el fosfato que se incorpora por la proteína quinasa, se remueve por la proteína fosfatasa Por eso es un proceso regulatorio, porque ocurre en un período determinado y es reversible. Así como una proteína quinasa se lo agrega, una proteína fosfatasa se lo quita. Todo este mecanismo se halla minuciosamente orquestado. Siempre una señal desencadenada por una hormona tiene un mecanismo de cierre. Cuando una señal se enciende, nunca continúa en forma indefinida”, precisa. Rebobinando los datos Volvamos al comienzo y recopilemos el procedimiento de transducción observado en este caso. Teníamos una determinada hormona o factor de crecimiento que es recibido por un receptor en la membrana. Esto trae como consecuencia el aumento de nivel del segundo mensajero, que es el AMP cíclico. En este caso, la proteína quinasa que se activa es la proteína quinasa A. Otras proteínas quinasas son responsables de transducir la señal de otras hormonas y tienen otros mecanismos de activarse en respuesta a la señal. Algunos se conocen y otros no. “El interés de este equipo –puntualiza– es estudiar el modo en que el aumento del AMP cíclico incrementa la actividad de la proteína quinasa A. El siguiente paso es saber qué proteínas son fosforiladas, cuáles son las primeras proteínas que fosforila y qué consecuencias les acarrea. Por ejemplo, qué propiedad cambió. Esto puede verse en el proceso final o puede haber más pasos previos que habría que dilucidar”. Pero esto no es todo. “Un concepto moderno y actualizado indica que las proteínas no están libres en el citoplasma o en el núcleo de la célula, sino que en general están localizadas e interactuando con otras proteínas. En el caso de la proteína quinasa A, -especifica- el estudio de su mecanismo de localización subcelular está directamente ligado al mecanismo de su activación por el AMP cíclico. Por este motivo, también se investiga la presencia de proteínas AKAP (del inglés A kinase anchoring proteins) que son proteínas que interaccionan fuertemente con la proteína quinasa A, conduciendo a su localización en algún compartimiento subcelular. Esta localización tendrá como consecuencia que al aumentar los niveles de AMP cíclico, y aumentar la actividad de la proteína quinasa A, ésta fosforile sólo proteínas de su entorno”. ¿Cuál sería la posible aplicación? Si bien las distintas líneas de investigación persiguen el conocimiento por éste mismo, es decir saber cómo funciona un área inexplorada de la célula; “hoy día en el mundo existen centros especialmente dedicados a estudiar inhibidores de proteínas quinasas o de proteínas fosfatasas, porque a veces, inhibiendo alguna de ellas, se logra disminuir alguna patología. Por ejemplo, la proteína quinasa G, prima hermana de la proteína quinasa A, fue el blanco indirecto de acción del conocido medicamento Sildenafil (conocido por su nombre comercial como Viagra)”, resalta. En tanto, este equipo del Departamento de Química Biológica no descansa en su intento de desentrañar este agujero negro celular, ya que con este conocimiento podría tenerse la llave de entrada para el diseño de drogas o fármacos específicos. Es que la proteína quinasa A es una enzima involucrada en procesos vitales como el funcionamiento de las neuronas, la adquisición de la memoria, en el crecimiento o diferenciación de la célula, en la regulación de las funciones reproductivas, en la respuesta inmune y en patologías tales como varias formas de diabetes, la hipertensión, las úlceras gástricas y el asma, entre otras.
(*) Centro de Divulgación Científica-SEGB-FCEyN.
|
||||||||||||||