|
|
||||||||||||||||||
|
12
de octubre de 2001
El
Nóbel de Química para la creación de Moleculas.
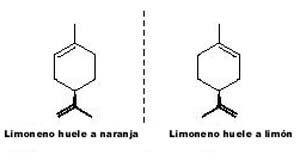
La revolución que representó el automóvil y la aviación, y que está basada en la utilización de derivados del petróleo como combustible, ha sido posible gracias a los catalizadores que permiten convertir gran parte del crudo en combustibles líquidos cada vez más limpios. Pero, incluso si pensamos en los combustibles del futuro tales como el hidrógeno o la biomasa, deberemos también pensar en catálisis y fotocatálisis. Estaremos todos de acuerdo en que sería difícil imaginar nuestra sociedad, e incluso la futura, sin los polímeros orgánicos (plásticos). Pues bien, gracias a los catalizadores de polimerización se dispone de una gran variedad de plásticos con propiedades tan diferentes. Sin embargo, es en la mayor revolución que se ha dado en este planeta, el nacimiento de la vida, donde la catálisis ha sido determinante. Si pensamos en la vida como en una serie de reacciones químicas autosostenidas y relacionadas, éstas necesitan, para llevarse a cabo a la velocidad y selectividad adecuadas, de unos catalizadores denominados enzimas. En muchos casos las enzimas están formadas por un átomo metálico central unido a una serie de ligandos de naturaleza orgánica. Algunos de estos catalizadores enzimáticos han tenido que aumentar su complejidad y adaptarse (¿o tal vez es al revés?) a una constante de la naturaleza que podríamos simplificar diciendo que 'a la vida no le gusta la simetría'. Así, si observamos nuestras manos, éstas no son superponibles, sino que una es la imagen especular de la otra. Por esta razón se las califica como quirales (del griego cheir, mano), y se habla del fenómeno de la quiralidad u orientación derecha o izquierda (en la naturaleza no se observa el centro sino derechas, izquierdas y mezclas racémicas de ambas). De la misma manera, si observamos los distintos tipos de gasterópodos (caracoles) terrestres o marinos, veremos que el sentido de la hélice de las conchas es siempre el mismo. Esta característica que se observa a nivel macroscópico también se produce a nivel molecular y existen moléculas en las que, aún estando formadas por los mismos átomos (misma composición química), el ordenamiento espacial es diferente, de tal manera que una es la imagen especular de la otra. Estas moléculas son quirales y a una forma y a su imagen especular se las denomina isómeros ópticos o enantiómeros, o isómeros L (del latín laevus, izquierdo), y D (dexter, derecho). La naturaleza, al menos tal y como la conocemos, ha alcanzado un elevado grado de especialización, y la vida utiliza exclusivamente proteínas L y ácidos nucleicos D. Podríamos decir que la vida es homoquiral y que, por tanto, para un tipo de moléculas dado no acepta más que una sola orientación. Este hecho obliga a que los receptores de nuestro organismo sean capaces de diferenciar estos isómeros ópticos y puedan acoplarse o ser excitados por tan solo uno de ellos. Así, en determinados medicamentos supresores del dolor dos moléculas con la misma composición química pero con distinta distribución de sus átomos en el espacio (dos moléculas quirales), se comportan de manera diferente y uno de los dos enantiómeros es 100 veces más efectivo que el otro. En otras ocasiones, la naturaleza ha desarrollado sensores diferentes para cada enantiómero y, así, una molécula como el Limoneno puede oler a limón o naranja dependiendo del enantiómero que se considere. En algunos casos la selectividad de nuestros receptores por uno de los isómeros ópticos L o D la hemos aprendido a costa de sufrimientos. En los '60 los médicos trataban las náuseas de las mujeres embarazadas con el medicamento Talidomida. Los laboratorios fabricaban la molécula activa, que era quiral, como una mezcla de las formas L y D. Desgraciadamente, uno de los isómeros era nocivo para el desarrollo del feto dando lugar a niños malformados. Todo esto ha llevado a los químicos a tratar de sintetizar en el caso de moléculas quirales uno y solo uno de los enantiómeros o isómeros ópticos. Pero si esto lo hacen diariamente las enzimas en nuestro organismo, ¿por qué no diseñar catalizadores que fueran capaces de reconocer a nivel molecular estos isómeros y pudiesen dirigir la reacción hacia la formación de uno u otro isómero? Es precisamente por sus trabajos en el desarrollo de catalizadores quirales que Willliam S. Knowles y Ryoji Noyori, y Barry Sharpless, han sido galardonados este año con el premio Nóbel de Química. Ellos fueron los pioneros en el uso de complejos metálicos moleculares como catalizadores en síntesis asimétrica. Los primeros pasos en el campo de la hidrogenación asimétrica los dio a mediados de los '60 Knowles en la compañía Monsanto y Noyori en la Universidad de Nagoya. Ambos investigadores no sólo llevaron a cabo investigaciones fundamentales sobre catálisis asimétrica en hidrogenación, sino que además fueron capaces de transferir dichos conocimientos a la industria y solucionar problemas que requerían atención urgente en los campos de la medicina y de la química fina. Es decir, no sólo investigaron para el futuro muy lejano, sino que también lo hicieron para un futuro mucho más próximo del que afortunadamente nosotros nos beneficiamos. Knowles (prácticamente al mismo tiempo que el profesor Kagan en Francia) descubrió que es posible llevar a cabo síntesis quirales, y por tanto sintetizar preferentemente uno de los dos isómeros ópticos de los que hablamos antes, utilizando complejos de metales de transición con ligandos quirales y aplicándolos a procesos de hidrogenación. Sin embargo, en ciencia raramente se producen saltos en el vacío sino que en cada paso se utilizan los avances conseguidos por otros investigadores. En el caso del trabajo pionero de Knowles, éste se basó en los trabajos de Osborn y Wilkinson sobre complejos de metales de transición como catalizadores de hidrogenación no quirales, y en el desarrollo de fosfinas quirales por Horner y Mislow. En una primera etapa, Knowles demostró que introduciendo como ligando una fosfina quiral al catalizador de Wilkinson era posible obtener un pequeño exceso enantiomérico del 15%: es decir, enriquecer el producto en uno de los dos isómeros ópticos. Este éxito, aunque modesto, dio ánimos al investigador para sintetizar un gran número de fosfinas quirales con estructuras diferentes, encontrando que algunas de éstas unidas al rodio eran capaces de llevar a cabo la hidrogenación selectiva de la fenilalanina para producir L-DOPA con un 97,5% de rendimiento. Este descubrimiento ha contribuido enormemente a mejorar la calidad de vida de los enfermos de Parkinson. Noyori presentó en 1966 el primer ejemplo de catálisis asimétrica (ciclopropanación) con un complejo organometálico de cobre bien definido. Aunque los primeros resultados dieron rendimientos (excesos) enantiómericos bajos, éstos animaron a este investigador y a otros a proseguir las investigaciones. Posteriormente, Noyori publicó la síntesis de los dos enantiómeros de un nuevo ligando difosfina, el BINAP. Complejos de BINAP con rodio y rutenio le han permitido llevar a cabo la hidrogenación asimétrica de cetonas funcionalizadas, así como de ácidos a, b- y b, g-insaturados para producir los ácidos saturados óptimamente activos. Sus trabajos de hidrogenación enantioselectiva han permitido la obtención del enantiómero más activo del Naproxen (97% de exceso enantiómerico) que es un antiinflamatorio no esteróideo de amplio uso en medicina. Sus estudios fundamentales sobre efectos electrónicos y geométricos en los ligandos de los catalizadores de hidrogenación le han permitido realizar síntesis industriales como, por ejemplo, la del antibiótico Lexofloxacin, así como de distintas fragancias comercializadas por la empresa Tagasako (M. Susarte, Acedesa-Tagasako).
* La versión original de esta nota fue publicada en el diario El País de España.)
|
|||||||||||||||||